Результати досліджень та їх аналіз

Наші наступні дослідження в цьому напрямку дали змогу експериментально обґрунтувати можливість низькотемпературної консервації суспензії ембріональних клітин курей. Для цього суспензію ембріональних клітин, підготовлену відомим методом (Терещенко О.В. та ін., 1993), поміщають у фосфатно-сольовий буфер з осмотичністю 285 — 310 мОсм при температурі 20 °C. За два прийоми загальною тривалістю 10… Читати ще >
Результати досліджень та їх аналіз (реферат, курсова, диплом, контрольна)
Удосконалення технології заморожування сперми гусаків Мета цих досліджень полягала в такому удосконаленню відомої технології (Сахацький М.І., 1984), яке давало б можливість проводити консервування сперми гусаків у вигляді облицьованих гранул. При проведенні пошукових досліджень в напрямку вивчення різних матеріалів вибір було зроблено на використанні облицювального матеріалу, поліетиленової трубки, яка застосовується в Харківській технології кріоконсервації сперми бугаїв.
Результати досліджень по розробці режиму охолодження сперми гусаків у вигляді облицьованих гранул об'ємом 0,3 мл наведені на рис. 2. Вони свідчать про те, що рухливість сперміїв починає різко знижуватися після охолодження зі швидкістю 50 — 60°C/хв. до температури -90°C і нижче. Але абсолютний показник живучості сперміїв свідчить, що погіршення їх життєздатності починається раніше, при охолодженні до температури -86°C. Тому доцільно застосовувати режим охолодження, який передбачав би перехід з однієї швидкості на іншу при температурі зразків -86°С. Це положення було використано при експериментальному обґрунтуванні режиму охолодження сперми гусаків за двома ступенями: спочатку від 0 °C до -86°С — із швидкістю 50°C/хв., потім — до -196°C із швидкістю 8 — 15°C/хв.
Застосування облицювального матеріалу спричинило також проведення досліджень щодо необхідності внесення змін в відомий режим розморожування сперми. За допомогою методу біологічного контролю було визначено, що розморожування необхідно проводити за ступінчастим режимом, а саме: протягом 1 хвилини у водяній бані при 0 — 2 °C, а після цього при 40 °C до зникнення твердої фази в гранулах. Заплідненість яєць при вживанні такої сперми для осіменіння гусей склала 91,0±2,2 (таблиця 1.).
Отже, внаслідок проведених досліджень експериментально обґрунтовані технологічні прийоми заморожування сперми гусаків в облицьованих гранулах об'ємом 0,3 мл. При вживанні розмороженої сперми для осіменіння гусок забезпечується заплідненість яєць на рівні 85,1 — 91,0%, вивід гусят — 66,3 — 72,9%, що відповідає показникам, які спостерігаються при природному спарюванні гусей.
Розробка експрес-методів визначення запліднюючої здатності сперми півнів.
Для визначення якості сперми найчастіше застосовують такі методи: визначення рухливості і живучості сперматозоїдів, цілісність їх голівок при фарбуванні еозiн-нiгрозiном та іншими барвниками, ряд біохімічних тестів. Але жодний з цих методів не дає можливості об'єктивно визначити її запліднюючу здатність. Це стосується і флуоресцентного методу з використанням етідіум броміду. Цей барвник повільно дифундує через нативні мембрани клітин, але швидко проникає в ушкоджені голівки сперматозоїдів, що призводить до їх інтенсивної люмінесценції. Таким чином, цей метод дає можливість швидко визначити кількість сперматозоїдів з ушкодженими голівками, але не забезпечує точного прогнозування запліднюючої здатності сперми, тому що цей показник залежить більше всього від стану акросом. Тому наші дослідження були спрямовані на пошук флуорохрому, який надав би можливість визначити ушкодження акросом. З вивчених флуорохромів (акрiдiновий оранжевий, ауромiн 00, кальцеїн, конго червоний, корiфосфiн, метиленовий зелений, a-нафтiламiн, тетразолiєвий синій, тетрациклiн, тiазiновий червоний, примулiн, хiнiн, флуоресцеїн, еозiн) саме тіазіновий червоний відповідає таким вимогам. Крім цього, була вивчена можливість використання цього барвника в суміші з етідіум бромідом. Це дало змогу визначати одночасно ушкодження голівок і акросом сперматозоїдів та з високої точністю (коефіцієнт кореляції r=0,93) прогнозувати запліднюючу здатність сперми. Нами експериментальним шляхом визначена оптимальна концентрація тіазінового червоного в цій суміші (0,005 — 0,008%) та етідіум броміду (0,0008 — 0,0015%). Зразки сперми змішують з цим флуорохромом та вивчають під люмінесцентним мікроскопом. При цьому на темно-синьому фоні добре видно того ж кольору, але менш забарвлені, сперматозоїди, які є неушкодженими. При ушкодженні акросоми тіазіновий червоний забарвлює її в світло-салатовий колір. Ще більше ушкодження акросоми, пов’язане з порушенням її морфологічної структури, супроводжується її інтенсивним червоно-коричневим забарвленням. При ушкодженні голівок сперматозоїдів етідіум бромід фарбує їх в яскраво-малиновий колір. Таким чином, розробка флуорохрому та параметрів його використання при роботі зі спермою півнів дала змогу за 5 — 10 хвилин визначати її запліднюючу здатність за станом акросом та голівок статевих клітин.
Подальші дослідження в цьому напрямку дали змогу виявити ще один флуорохром a-нафтiламiн, який ще краще та швидше визначає ушкодження акросом та голівок сперматозоїдів півнів. Цей флуорохром адсорбується на поверхні мембран сперматозоїдів та викликає їх люмінесценцію салатового кольору. Тому сперматозоїди є ніби окреслені за контуром, що дає змогу виявляти будь-які незначні ушкодження всіх його складових частин від акросоми до хвоста. Використання цього флуорохрому дає змогу визначити запліднюючу здатність сперми півнів з високої кореляцією (r=0,97, при Р<0,05) за 3−5 хвилин.
Розробка лабораторних експрес-методів визначення запліднюючої здатності сперми півнів за станом статевих клітин, особливо за станом їх акросом, які є найбільш вразливими частинами, дала змогу суттєво прискорити виконання досліджень по її низькотемпературній консервації.
Розробка технології заморожування сперми півнів.
При заморожуванні сперми півнів зі швидкістю 2 та 10°C/хв ушкодження сперматозоїдів спостерігаються при їх охолодженні до -10 — -30°C (табл.2). Кількість сперматозоїдів з неушкодженими мембранами голівок при цьому не перевищує 25 — 40%. Але всі вони мають ушкоджені акросоми. Такі ушкодження в цій температурній зоні пов’язані з перебуванням клітин в жорстких умовах. Так, внаслідок виморожування води спостерігається підвищення концентрації електролітів і інших речовин, зміна іонної сили розчину, рН і осмотичного тиску. Це призводить до лiотропного руйнування, надлишкової дегідратації, порушення іонного балансу клітин. Всі ці фактори особливо небезпечні для акросом, в яких знаходяться гiдролiтичні ферменти в неактивній формі. Заморожування сперми із швидкістю 40°C/хв теж викликало ушкодження клітин внаслідок різких осмотичних змін і внутрішньоклітинного кристалоутворення.
Як свідчать наведені в таблиці 2 дані, охолодження сперми півнів з будь-якою лінійною швидкістю призводить до ушкодження акросом у всіх клітин вже при -30°С. Ці та інші наші дослідження дали змогу виявити три критичні зони, які найбільш небезпечні при охолоджуванні сперми півнів до -196°С, а саме: від 0 °C до початку процесу кристалізації; в межах -16 — -22°С та -80 — -90°С. Такі обставини свідчили про необхідність розробки ступінчастого режиму охолодження. Найкращі результати були одержані при охолодженні сперми півнів від 0 °C до початку процесу кристалізації зі швидкістю 3°С/хв та витримуванні на плато кристалізації протягом 1 -3 хвилин. На рис. 3 та 4 наведені результати експериментів, які свідчать про те, що сперму півнів необхідно охолоджувати від початку процесу кристалізації до -16 — -22°С зі швидкістю 30°С/хв, а потім до -80°С — -90°С — зі швидкістю 70°С/хв., після цього зразки слід занурювати в рідкий азот для швидкого охолодження до -196°С.
Життєздатність сперматозоїдів при їх заморожуванні в значній мірі залежить і від складу кріозахисного середовища. Тому наші дослідження були направлені також і на удосконалення відомих середовищ, що використовуються для заморожування сперми півнів. Для цього нами був використаний план Плакетта-Бауера (Адлер Ю.П. та інші., 1976). Це дало можливість визначити, що компоненти по різному діють на.
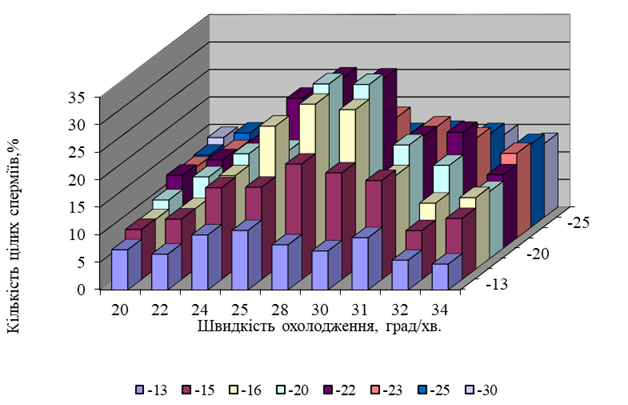
Рис. 3. Життєздатність сперматозоїдів півнів залежно від швидкості їх заморожування від точки кристалізації до -30°С.
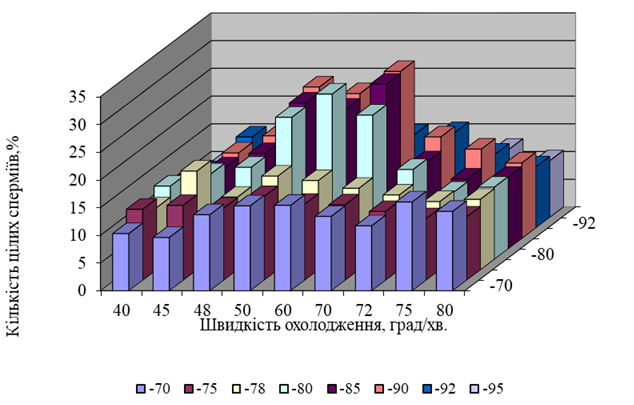
Рис. 4. Дія швидкості охолодження сперми півнів від -16 — -22°С до -95°С на життєздатність статевих клітин.
показники якості сперматозоїдів. Компонентами, які покращують їх рухливість, являються гліцин, глюкоза, сульфат марганцю, полiвiнiлпiрролiдон, а тими, які знижують, — iнозiт і цитрат калiю. Позитивно впливають на зберігання голівок сперматозоїдів протамiн сульфат, ПВП і овомукоїд, негативно — гліцин. Введення в склад захисного середовища глюкози, iнозiту, протамiн сульфату, ацетата магнiю і овомукоїду сприяє підвищенню збереженості акросом сперматозоїдів в процесі заморожування-відтавання. Це дозволило виділити компоненти захисного середовища, які сприяли виживанню сперматозоїдів при заморожуванні, та швидко розробити нове захисне середовище під назвою С-2 такого складу (г%): глутамат натрію — 2,85, глюкоза — 0,50, інозіт — 0,25, ацетат магнію — 0,07, ацетат калію — 0,50, полівінілпірролідон — 0,20, протамін сульфат — 0,028. Осмотичність цього середовища складає 350 — 400 мОсм. Захисну функцію воно набуває при додаванні до його складу диметілформаміду.
В цілому розроблена нами технологія заморожування сперми півнів здійснюється в такій послідовності. Свіжоодержану сперму півнів розводять середовищем С-2 без кріопротектора у співвідношенні 1: 1 при температурі 20 — 25 °C та зберігають в холодильнику (4°C) протягом 40 — 45 хвилин. Після цього сперму ще раз розводять середовищем С-2 з крiопротектором у співвідношенні 2:1. Як кріопротектор, використовують диметiлформамiд в кінцевій концентрації 7%. Зразу після другого розведення спермою заповнюють поліетиленові трубки (пайєти) типу «СЖ», які заморожують за такої програмою: зі швидкістю 3°C/хв до початку кристалізації, витримують протягом 1 — 3 хвилин на плато кристалізації, після цього зі швидкістю 30°C/хв до -16 — -22°C, 70°C/хв до -80 — -90°C, а потім занурюють в рідкий азот. Розморожування зразків здійснюють на водяній бані при 40 °C. Штучне осіменіння курей розмороженою спермою здійснюють дозою 0,12 мл з частотою один раз в три — чотири дні. При цьому пайєту вводять в статевий шлях курей на глибину 2−3 см. Ця технологія забезпечує заплідненість яєць на рівні 75 — 85%, вивід курчат -70 — 75%.
Розроблена технологія низькотемпературної консервації сперми в пайєтах була використана нами для накопичення сперми півнів рідкісних порід в низькотемпературному банку генів, що створений при Інституті птахівництва УААН. На даний час в цьому банку зберігається сперма півнів дев’яти рідкісних порід.
Слід наголосити, що сперма півнів рідкісних порід нами не тільки була накопичена в низькотемпературному банку, але й вжита при відновленні зниклих порід, а до селекціонованих ліній було застосовано «прилиття крові» від курей німецької селекції. Після використання заморожено-відталої сперми заплідненість яєць склала 80,2%, виводимість курчат — 90,2%. Дев’ятирічне зберігання не виявляє негативного впливу на відтворювальні якості консервованої сперми. Так, завдяки цьому запасу сперми, який зберігався 9 років, колекційне стадо курей дослідного господарства «Борки» в 2001 році було поновлено ще трьома рідкісними породами: голошийна, падуан, українська вушанка.
Експериментальне обґрунтування можливості низькотемпературної консервації суспензії ембріональних клітин курей.
Для проведення досліджень використовували ембріональні клітини, одержані з ембріонів, які знаходяться на стадії кінця бластули — початку гаструли. На цій стадії розвитку ембріону його клітини ще зберігають тотiпотентні властивості (Marzullo G., 1970) та є легкодоступні, тому що знаходяться в свіжознесеному яйці. Дослідження були розпочаті нами з удосконалення методу контролю життєздатності цих ембріональних клітин. Вони показали, що для визначення життєздатності ембріональних клітин доцільно застосовувати 1−10 мкМ розчин етiдiум бромiду на фосфатно-соляному буфері. При цьому дуже важливо, щоб підготовка препарату для мікроскопування не перевищувала 1 хвилини, а на розподіл 100 — 200 клітин на нормальні та ушкоджені було витрачено не більше 5 хвилин. Це пояснюються тим, що етідіум бромід забарвлює не тільки ушкоджені ембріональні клітини, але й нормальні. Різниця полягає тільки в швидкості його проникнення в клітини. Так, в ушкоджених клітинах він з’являється зразу ж та викликає їх яскраву малиново-червону люмінесценцію при 580 — 610 нм. З нормальних клітин (життєздатних, неушкоджених) він фарбує 2% з них тільки через 10 хвилин. Таким чином, при загальних витратах часу на одне визначення не більш 5 — 7 хвилин, цей метод гарантує об'єктивний розподіл ембріональних клітин в суспензії на життєздатні та ушкоджені (в %).
Наявність такого об'єктивного та швидкого методу сприяла прискоренню досліджень по низькотемпературному консервуванню ембріональних клітин. В таблиці 3 наведені дані по вивченню дії кріопротектору на життєздатність ембріональних клітин.
Аналіз наведених в таблиці 3 експериментальних даних свідчить про те, що при експозиції ембріональних клітин з крiопротекторами до 5 годин чисельність життєздатних з них залишається на високому рівні. Після 24-годинної експозиції спостерігається вірогідне (при Р<0,05) зниження кількості життєздатних клітин у присутності гліцерину, етиленгліколю і пропiленгліколю. Ці дослідження свідчать про доцільність використовування, як кріопротектора, ДМСО. При його введенні крапельним методом чисельність життєздатних клітин в суспензії зростає і стає такою ж, як і в контролі.
В таблиці 4 наведені експериментальні дані щодо двохступінчастого режиму заморожування ембріональних клітин. Для цього клітини спочатку заморожують до приведеного в таблиці показника температури, а потім їх занурюють в рідкий азот. До заморожування кількість життєздатних клітин в суспензії складала 93,6±0,4%. Попереднє охолодження суспензії зі швидкістю 1, 3 або 10°С/хв до -10°С з послідуючим занурюванням в рідкий азот, як свідчать дані в таблиці 4, спричиняє загибель значної кількості ембріональних клітин. Значно кращі результати одержані при охолодженні суспензії клітин зі швидкістю 1°С/хв до -30°С з наступним занурюванням в рідкий азот.
Наші наступні дослідження в цьому напрямку дали змогу експериментально обґрунтувати можливість низькотемпературної консервації суспензії ембріональних клітин курей. Для цього суспензію ембріональних клітин, підготовлену відомим методом (Терещенко О.В. та ін., 1993), поміщають у фосфатно-сольовий буфер з осмотичністю 285 — 310 мОсм при температурі 20 °C. За два прийоми загальною тривалістю 10 хвилин крапельним методом до цієї суспензії додають диметилсульфоксид до кінцевої концентрації 10%. Після цього суспензією заповнюють пайєти, які охолоджують зі швидкістю 1°С/хв до температури -30°С. Дуже корисним при цьому, для підвищення життєздатності ембріональних клітин, є ініціація процесу кристалоутворення при -6°С шляхом дотику до верхньої частини кожної з них охолодженого в рідкому азоті металевого предмету, наприклад пінцету. Після охолодження пайєт до -30°С їх необхідно негайно занурити в рідкий азот для швидкого охолодження до -196°С. Затримка цього процесу до 3 — 6 хвилин приводить до зниження життєздатності ембріональних клітин. Для розморожування пайєти занурюють у водяну баню при 40 °C до появи рідкої фази в законсервованій суспензії. Після цього суспензію з пайєт переносять у пробірку, розбавляють в 5 — 10 разів розчином фосфотно-сольового буферу без кріопротектора (ступінчасто за 5 -10 прийомів), визначають життєздатність клітин та використовують для біотехнологічних досліджень та робіт. Здійснення перелічених вище технологічних прийомів в розробленій нами послідовності гарантує одержання при заморожуванні - розморожуванні чисельністі життєздатних ембріональних клітин в суспензії на рівні 80 — 90%.