Вітамін В12.
Характеристика та класифікація білків, вітамінів, ферментів

КФ 6.1 включає лігази, що формують зв’язки вуглець-кисень КФ 6.2 включає лігази, що формують зв’язки вуглець-сірка КФ 6.3 включає лігази, що формують зв’язки вуглець-азот (включаючи аргінінсукцинат-синтетазу) КФ 6.4 включає лігази, що формують зв’язки вуглець-вуглець КФ 6.5 включає лігази, що формують фосфодиестерні зв’язки КФ 6.6 включає лігази, що формують зв’язки азот-метал У відповідності… Читати ще >
Вітамін В12. Характеристика та класифікація білків, вітамінів, ферментів (реферат, курсова, диплом, контрольна)
Вітамін В12 або Кобаламін — це вітамін групи В, бере участь у кровотворенні, регулює вуглеводний і жировий обмін в організмі. При авітамінозі розвивається недокрів'я — анемія.
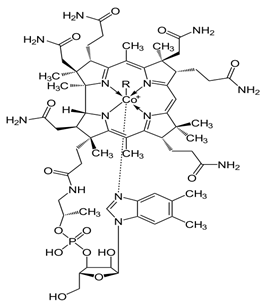
Кобаламін відіграє надзвичайно важливу роль у правильному функціонуванні нервової системи, впливаючи, таким чином, на роботу всіх органів. Якщо в організмі бракує вітаміну В12, це також призводить до дефіциту вітаміну В1, навіть при достатній його кількості в їжі. Дефіцит кобаламіну може призвести також до розладу залоз внутрішньої секреції, мозку, призвести до захворювання бері-бері (поліневрити), порушення травлення. Хронічна недостатність його призводить до необоротного руйнування нервів. Міститься в молочних продуктах, яєчному жовтку, м’ясі, печінці, нирках і рибі.
Функції.
Вміст вітаміну В12 у крові мало у людей, які страждають на хворобу Альцгеймера і деякими іншими психічними розладами. Цей вітамін бере активну участь в обміні білків, жирів і вуглеводів в тісній взаємодії з вітаміном С, фолієвої та пантотенової кислотами. Вітамін В12 бере участь в метаболізмі фолієвої кислоти при виробленні холіну. Він оживляє також запаси заліза в нашому організмі, яких, як правило, не вистачає. За мільйони років свого розвитку вітамін В12 міцно подружився з вітаміном А, якій він допомагає в синтезі тканин тіла. Він забезпечує вступ каротинів в обмін речовин і їх перетворення в активний вітамін А. Нарешті, у взаємодії з іншими речовинами вітамін В12 запускає основний життєвий процес — синтез дезоксирибонуклеїнової і рибонуклеїнової кислот. Це білкові речовини, з яких складаються клітинні ядра і які містять всю спадкову інформацію.
Потреба в вітаміні В12.
Мінімальна денна норма становить 3 мкг на добу. Чисті вегетаріанці (вегани) залишаються без нього, якщо не отримують добавок або збагаченої їжі.
Антагоністи вітаміну В12.
Прийом протизаплідних засобів і великої кількості різних ліків може вичерпати весь запас вітаміну В12. Крім того, для засвоєння кобаламіна необхідно особливу речовину, так званий внутрішній фактор, який виробляється в організмі і знаходиться в шлунковому соку. Без нього навіть найбільша кількість вітаміну B12 буде погано засвоюватися. Є люди, в організмі яких він взагалі не синтезується. Це стосується в основному людей похилого віку, чия травна система знижує виділення певних кислот (наприклад, соляної). Якщо кислоти не виділяються у необхідній кількості, то речовина не синтезується, і тоді залізо і вітамін В12 засвоюються гірше, що може призвести до анемії. У таких випадках кращі результати дають ін'єкції вітаміну В12, а не таблетки, які до того ж погано поєднуються з залізом. Однак кислота ягід, фруктів, овочів, яблучний оцет підтримують потрібний рівень кислотності в організмі. Тому треба постійно стежити, щоб в організм надходило достатню кількість вітамінів В1, В6, В2 та В12 разом з натуральними продуктами.
Дефіцит вітаміну В12.
За останніми даними, дефіцит вітаміну B12 призводить також до нестачі карнітину, так званого квазівітаміна. Ця речовина виловлює в крові молекули жиру та транспортує їх в мітохондрії - «електростанції» клітин, де вони окислюються, даючи енергію всьому організму. Без карнітину утримання продуктів розпаду в крові підвищується, тому що жир залишається непереробленими. Для засвоєння вітаміну B12 у кишечнику потрібно достатня концентрація кальцію.
Джерела вітаміну В12.
Джерела вітаміну В12 — печінка, м’ясо, риба, морепродукти, молочні та кисломолочні продукти, яйця, і т.д. Найбільші джерела вітаміну В12 — яловича і теляча печінка. Її рекомендовно вводити в раціон хоча б один раз на тиждень тушковану або смажену з цибулею, додаючи до неї салат.
Класифікація ферментів Основу життєдіяльності будь-якого організму складають хімічні процеси. Практично усі реакції у живому організмі відбуваються за участю природних біокаталізаторів, які називаються ферментами, або ензимами. Серед великої кількості енергетично можливих реакцій ферменти вибірково перетворюють реагенти, що називаються субстратами, по фізіологічно корисному шляху. Таким чином, ферменти керують усіма метаболічними процесами організму.
В науковій літературі українською мовою затвердились обидва терміни: «ферменти» та «ензими», але перевагу надають терміну «фермент», хоча наука про ферменти називається ензимологією. Слово «фермент» походить від лат. fermentum — закваска, а «ензим» — від гр. en — в, всередині і zyme — дріжджі. Дана термінологія виникла історично під час вивчення ферментативних процесів спиртового бродіння.
Кожен фермент має дві назви. Перша — коротка, так звана робоча, зручна для повсякденного користування. Друга (більш повна) — систематична, що використовується для однозначної ідентифікації ферменту.
У назві більшості ферментів міститься суфікс «аза», приєднаний до назви субстрату реакції, наприклад, уреаза, сахараза, ліпаза, нуклеаза або до назви хімічного перетворення певного субстрату, наприклад, лактатдегідрогеназа, аденілатциклаза, фосфоглюкомутаза, піруваткарбокси-лаза. Згідно українській класифікації ферментів (КФ), назви ферментів пишуться разом. Але у вжитку зберігся ряд тривіальних, історично закріплених назв ферментів, які не дають уявлення ні про субстрат, ні про тип хімічного перетворення, наприклад трипсин, пепсин, ренін, тромбін.
Міжнародний союз біохімії і молекулярної біології у 1961 р. розробив систематичну номенклатуру, згідно якої усі ферменти розбиті на 6 основних класів у залежності від типу хімічної реакції, яку вони каталізують. Кожен клас складається з чисельних підкласів і підпідкласів з урахуванням перетворюваної хімічної групи субстрату, донора та акцептора перетворюваних груп, наявність додаткових молекул і т.д. Кожен з 6-ти класів має свій порядковий номер, чітко за ним закріплений.
Перший клас ферментів «Оксидоредуктази» каталізують різні окисно-відновні реакції за участю двох субстратів (перенесення електронів або атомів водню з одного субстрату на інший). Систематичну назву ферментів складають за формулою «донор: акцептор — оксидоредуктаза», робочу — субстрат-підклас оксидо-редуктаз.
До підкласу дегідрогенази входять ферменти, що каталізують реакції дегідрування (відщеплення водню). В якості акцепторів водню використовуються коферменти NAD+, NADP+, FAD, FMN (див. нижче). Усі ферменти цієї групи володіють високою субстратною специфічністю. Приклад реакції:

Ферменти, що відносяться до підкласу оксидази каталізують реакції, в яких акцептором електрону служить молекулярний кисень. Приклад реакції, що каталізується цитохромоксидазою:
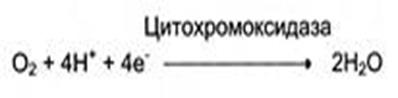
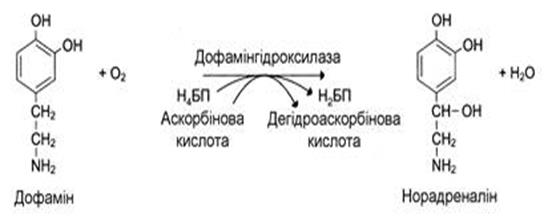
Оксигенази (гідроксилази) — каталізують реакції перенесення на субстрат атому оксигену з молекули кисню на субстрат.
Приклад реакції:
Згідно з міжнородною класифікацією ферментів, оксидоредуктази відносяться до 1 класу ферментів, в межах якого виділяють 22 підкласи:
КФ 1.1 — ферменти, що взаємодіють з CH-OH-групою донорів;
КФ 1.2 — ферменти, що взаємодіють з альдегідною або оксо-групою донорів;
КФ 1.3 — ферменти, що взаємодіють з CH-CH-групою донорів;
КФ 1.4 — ферменти, що взаємодіють з CH-NH2 групою донорів;
КФ 1.5 — ферменти, що взаємодіють з CH-NH групою донорів;
КФ 1.6 — ферменти, що взаємодіють з НАД · H або НАДФ · H;
КФ 1.7 — ферменти, що взаємодіють з іншими азотмістячими сполуками в якості донорів;
КФ 1.8 — ферменти, що взаємодіють з сіркомістячою групою донорів;
КФ 1.9 — ферменти, що взаємодіють з гемовою групою донорів;
КФ 1.10 — ферменти, що взаємодіють з діфенолами та спорідненими сполуками соединениями в якості донорів;
КФ 1.11 — ферменти, що взаємодіють з пероксидом в якості акцептора (пероксидази);
КФ 1.12 — ферменти, що взаємодіють з воднем в якості донорів;
КФ 1.13 — ферменти, що взаємодіють з одиночними донорами із вбудуванням молекулярного кисню (оксигенази);
КФ 1.14 — ферменти, що взаємодіють з парними донорами з вбудовуванням молекулярного кисню;
КФ 1.15 — ферменти, що взаємодіють з супероксид-радікалами в якосі акцепторів;
КФ 1.16 — ферменти, що окилюють іони металів;
КФ 1.17 — ферменти, що взаємодіють з CH или CH2 групами;
КФ 1.18 — ферменти, що взаємодіють з залізосірчаними білками в якості донорів;
КФ 1.19 — ферменти, що взаємодіють з відновленим флаводоксином в якості донора;
КФ 1.20 — ферменти, що взаємодіють з фосфором или миш’яком в яксті донора;
КФ 1.21 — ферменти, що взаємодіють з молекулами виду X-H и Y-H з утворенням зв’язку X-Y;
КФ 1.97 — решта оксидоредуктаз.
Другий клас ферментів «Трансферази» каталізують реакції перенесення функціональних груп від однієї сполуки до іншої. Їх класифікують в залежності від групи, що переноситься. Назву цих ферментів складають за формулою «донор: акцептор — транспортована група — трансфераза». До класу трансфераз належать амінотрансферази, ацилтрансферази, метилтрансферази, глікозилтрансферази, кінази (фосфотрансферази). Приклади реакції:

Класифікація згідно з міжнародною класифікацією і номенклатурі ферментів трансферази відносяться до 2 класу, в межах якого виділяють дев’ять підкласів:
КФ 2.1 включає ферменти, що переносять одноуглеродние групи;
КФ 2.2 — ферменти, переносять альдегідні і кетони групи;
КФ 2.3 — переносять ацільні залишки (ацілтрансферази);
КФ 2.4 — переносять залишки цукрів (глікозилтрансферази);
КФ 2.5 — переносять алкільні і арильному групи за винятком метильного залишку;
КФ 2.6 — переносять групи атомів, містять азот;
КФ 2.7 — переносять фосфор-містять залишки;
КФ 2.8 — переносять групи, що містять сірку;
КФ 2.9 — переносять групи, що містять селен.
Третій клас ферментів «Гідролази» каталізують реакції гідролізу (розщеплення ковалентного зв’язку з приєднанням молекули води по місцю розриву). Розділяють на підкласи в залежності від зв’язку, що розщеплюється. Назва ферментів складається за формулою «субстрат-гідролаза» або прямим приєднанням до назви субстрату суфіксу «аза», наприклад протеаза, ліпаза, фосфоліпаза, рибонуклеаза. Приклад реакції:
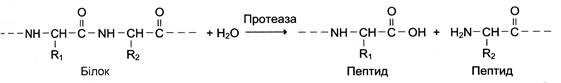
Для окремих класів гідролаз використовують спеціальні терміни, що характеризують гідроліз певного хімічного зв’язку: естерази, фосфатази та ін.
Згідно з міжнародною класифікацією ферментів гідролази віднесені до класу (КФ 3). Клас, в свою чергу, підрозділяється на 13 підкласів в залежності від типу зв’язку, що гідролізується.
Підклас. | Зв’язок, що гідролізується. | Важливі представники. |
КФ 3.1. | складноефірний зв’язок. | естерази: нуклеаза, фосфодіестераза, ліпаза, фосфатаза. |
КФ 3.2. | цукри. | глікозидази: амілаза, гіалуронідаза, лізоцим та ін. |
КФ 3.3. | простий ефірний зв’язок. | |
КФ 3.4. | пептидний зв’язок. | протеази: трипсин, хімотрипсин, еластаза, тромбін, ренін та ін. |
КФ 3.5. | непептидний вуглець-азотний зв’язок. | дезамінази: аденозин-дезамінази, аденозин-дезамінази РНК, цитидін-дезамінази. |
КФ 3.6. | кислотний ангідрид. | кислотний ангідрид-гідролаза (геліказа, ГТФаза). |
КФ 3.7. | вуглець-вуглецевий зв’язок (C-C). | |
КФ 3.8. | галогенний зв’язок. | |
КФ 3.9. | азотно-фосфорний зв’язок (P-N). | |
КФ 3.10. | азотно-сірчаний зв’язок (S-N). | |
КФ 3.11. | вуглецево-фосфорний зв’язок (C-P). | |
КФ 3.12. | дисульфідний зв’язок (S-S). | |
КФ 3.13. | сірчано-вуглецевий зв’язок (C-S). |
Четвертий клас ферментів «Ліази» відщеплюють від субстратів негідролітичним шляхом певну групу (при цьому можуть відщеплюватися СО2, Н2О, NH2, SH2 та ін.) або приєднують молекулу води (найчастіше) по подвійному зв’язку. Назви ферментів складаються за формулою «субстрат-група, що приєднується або відщеплюється». Приклади реакцій:
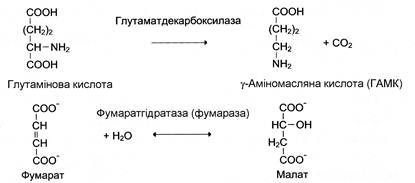
П’ятий клас ферментів «Ізомерази» каталізують різноманітні внутрішньомолекулярні перетворення. Їх класифікують у залежності від типу реакції ізомеризації. Як загальну назву ферментів цього класу використовують термін «ізомерази», наприклад:
Ізомерази можуть каталізувати внутрішньомолекулярні окисно-віднов-ні реакції, здійснюючи взаємоперетворення альдоз і кетоз, кетонних і енольних груп, переміщення подвійних зв’язків всередині молекули:
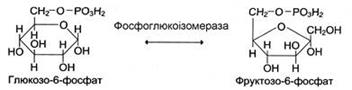

Коли ізомеризація полягає у внутрішньомолекулярному перенесенні групи, фермент називають мутазою, наприклад:

Шостий клас ферментів «Лігази» (синтетази) Каталізують реакції приєднання двох молекул одна до одної з утворенням ковалентного зв’язку. Цей процес спряжений з розривом фосфоефірного зв’язку у молекулі АТФ (або інших нуклеозидтрифосфатів) або з розривом макроергічних зв’язків інших сполук. У першому випадку (при використанні енергії гідролізу АТФ) такі ферменти називають лігазами або синтетазами:

У випадку, коли джерелом енергії слугує будь-яка інша макроергічна сполука (не АТФ), ферменти називають синтазами:
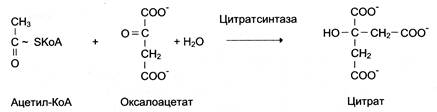
У класифікації міжнародної комісії з ферментів, лігази класифікуються як КФ 6 та поділяються на 6 підгруп:
КФ 6.1 включає лігази, що формують зв’язки вуглець-кисень КФ 6.2 включає лігази, що формують зв’язки вуглець-сірка КФ 6.3 включає лігази, що формують зв’язки вуглець-азот (включаючи аргінінсукцинат-синтетазу) КФ 6.4 включає лігази, що формують зв’язки вуглець-вуглець КФ 6.5 включає лігази, що формують фосфодиестерні зв’язки КФ 6.6 включає лігази, що формують зв’язки азот-метал У відповідності з класифікацією кожен фермент має систематичну назву, що однозначно характеризує хімічну реакцію, яку він каталізує. Наприклад, субстрат D-гліцеральдегід-3-фосфат: фермент NAD-оксидоредуктаза (робоча назва — гліцеральдегідфосфат дегідрогеназа). З назви ферменту випливає, що субстратом цього ферменту є D-гліцеральдегід-3-фосфат, тип каталізованої реакції - окисно-відновна в присутності коферменту NAD+.
У 1972 р. комісією з номенклатури біохімічних сполук Міжнародного союзу теоретичної та прикладної хімії були запропоновані «Правила номенклатури ферментів», що мають кодове чотиризначне цифрове позначення, де перша цифра означає клас ферменту, друга цифра (підклас) уточнює, яка група перетворюється, третя (підпідклас) уточнює додаткових учасників реакції (наприклад, донора і акцептора) і четверта — порядковий номер ферменту у даній підгрупі. Так, фермент малатдегідрогеназа має систематичну назву L-малат: NAD-оксидоредуктаза і має кодовий шифр 1.1.1.38. Шифр означає, що цей фермент належить до першого класу ферментів — оксидоредуктаз, окислювана група — гідроксильне угрупування (1) у присутності коферменту NAD+ (1) і порядковий номер ферменту у цій підгрупі - 38. Кодову номенклатуру ферментів восновному використовують в науковій літературі.