Комплексні з'єднання.
Комплексні з'єднання

Химические связи комплексообразователя с лигандами и ионами внешней сферы различны. В первом случае химическая связь имеет преимущественно ковалентный, а во втором — ионный характер. Вследствие этого в водных растворах комплексные соединения легко диссоциируют с отщеплением внешней сферы: ион константа лиганда. Комплексными соединениями называются такие соединения, в узлах кристаллов которых… Читати ще >
Комплексні з'єднання. Комплексні з'єднання (реферат, курсова, диплом, контрольна)
Комплексными соединениями называются такие соединения, в узлах кристаллов которых находятся сложные частицы (комплексы), способные к самостоятельному существованию не только в кристалле, но и в растворах. Например, в узлах кристалла соединения [Co (NH3)6]Cl3 находятся ионы Clи [Co (NH3)6]3+, эти же частицы существуют и в растворе.
В структуре комплексного соединения различают следующие структурные единицы:
центральная частица или комплексообразователь — в качестве такой частицы может служить ион или центральный атом;
лиганды — это атомы, группы атомов или ионы, связанные с центральной частицей;
число лигандов, связанных с комплексообразователем, называется координационным числом. Координационное число характеризует координационную ёмкость комплексообразователя;
центральный атом (комплексообразователь) и лиганды образуют внутреннюю сферу. Внутренняя сфера заключается обычно при записи комплексного соединения в квадратные скобки;
частицы вне внутренней сферы образуют внешнюю сферу и представляют собой катионы или анионы.
Рассмотрим пример: K4[Fe (CN)6].
Fe2+ - комплексообразователь;
CN- - лиганды, их 6;
[Fe (CN)6]4- - внутренняя сфера, имеет заряд 4-;
6 — координационное число (к. ч. = 6);
ионы К+ - внешняя сфера.
По характеру электрического заряда различают катионные, анионные и нейтральные комплексы. Например: [Ag (NH3)2]+, [Al (OH)4]-, [Pt (NH3)2Cl2]o.
По природе лигандов различают следующие комплексные соединения:
аквакомплексы — (лиганды — молекулы воды) [Cr (H2O)6]Cl3; [Cu (H2O)6]SO4.
аммиакаты — (лиганды — молекулы аммиака) [Cu (NH3)4]SO4; [Ag (NH3)2]Cl.
гидроксокомплексы — (лиганды — ионы ОН-) К 2[Zn (OH)4]; Na2[Sn (OH)6].
ацидокомплексы — (лиганды — кислотные остатки, т. е. анионы) K4[Fe (CN)6], K2[HgJ4].
комплексные соединения смешанного типа — (в одном комплексе различные лиганды) [Co (NH3)4Cl2]Cl, [Pt (NH3)4Cl2]Cl2.
Названия комплексных соединений образуются аналогично названиям простых солей, кислот и оснований с той лишь разницей, что указывают лиганды и степень окисления комплексообразователя. При этом лиганды называют:
Н 2О — «аква» ОН- - «гидроксо» SO42- - «сульфато» .
NH3 — «амин» Cl- - «хлоро» NO3- - «нитрато» .
СО — «карбонил» CN- - «циано» NO2- - «нитрито» .
В названии большинства лигандов окончанием служит буква «о». Исключений из этого правила немного. Например, «амин», «карбонил» .
Основные правила номенклатуры комплексов следующие:
в первую очередь называют катион (комплексный или простой); во вторую — анион (комплексный или простой);
название комплексной частицы начинается с лигандов, при этом указывается их число — ди-, три-, тетра-, пента-, гексаи т.д. Затем называют комплексообразователь (русское или латинское название) и указывается в скобках римскими цифрами его степень окисления;
3) если комплексная частица является анионом, то к названию комплексообразователя добавляется окончание — ат.
Примеры: Na2[PtCl6] - натрия гексахлороплатинат (IV);
[Cr (H2O)6]Cl3 — гексааквахрома (Ш) хлорид.
Химические связи комплексообразователя с лигандами и ионами внешней сферы различны. В первом случае химическая связь имеет преимущественно ковалентный, а во втором — ионный характер. Вследствие этого в водных растворах комплексные соединения легко диссоциируют с отщеплением внешней сферы: ион константа лиганда.
[Ag (NH3)2]Cl > [Ag (NH3)2]+ + Cl;
В то же время диссоциация комплексного иона идет в сравнении с первичной диссоциацией в незначительной степени, т. е. комплексный ион диссоциирует обратимо как слабый электролит:
[Ag (NH3)2]+ - Ag+ + 2NH3.
Вторичная диссоциация комплекса может быть охарактеризована константой равновесия, называемой константой нестойкости (КН):
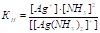
.
Константа нестойкости характеризует устойчивость комплекса: чем больше значение КН, т. е. чем больше концентрация в растворе ионов, на которые диссоциирует комплекс, тем слабее, более неустойчив комплекс, и наоборот.