Взаємодія оловохлоридних комплексів паладію з силікагелями, що містять сірковмісні функціональні групи

Сорбцію оловохлоридних комплексів паладію (ІІ) на сорбентах вивчали в статичному режимі за різних значень pH. Кислотність розчинів контролювали рН-метром-мілівольтметром рН-150М. Повноту сорбції розраховували як різницю між початковою і рівноважною концентрацією металу у водній фазі. Рівноважну концентрацію паладію у водній фазі визначали на атомноабсорбційному спектрофотометрі «Сатурн-2М… Читати ще >
Взаємодія оловохлоридних комплексів паладію з силікагелями, що містять сірковмісні функціональні групи (реферат, курсова, диплом, контрольна)
Вступ
У сучасних технологічних процесах і хімічному аналізі широко використовуються органополімерні сорбенти, що мають у своєму складі функціональні групи, які здатні до комплексоутворення чи іонного обміну.
Поряд з високою сорбційною здатністю і ємністю органополімерних сорбентів у них є ряд недоліків, серед яких низька швидкість установлення сорбційної рівноваги, трудність у багатьох випадках кількісної десорбції сорбованих іонів. Це значною мірою обмежує їхнє використання, особливо в аналітичній хімії. Указані недоліки не притаманні хімічно модифікованим кремнеземам [3]. Однак використання їх є обмеженим через досить високу вартість.
В останні роки значна увага приділяється синтезу та використанню сорбентів на основі дисперсних неорганічних носіїв з фіксованими на поверхні органополімерами.
За рахунок багатоцентрової сорбції зв’язок полімеру з поверхнею може не поступатись за міцністю ковалентному зв’язуванню молекул. У роботі [2] нами показано перспективність використання як полімерного модифікатора поверхні кремнезему полігексаметиленгуанідин хлориду (ПГМГХ). Вибір ПГМГХ є невипадковим.
По-перше, ПГМГХ водорозчинний полімер, що істотно полегшує умови синтезу сорбентів на його основі.
По-друге, до складу даного полімеру входять гуанідинові групи, що, з одного боку, можуть самі в результаті протонування вступати в реакції іонного обміну, а з іншого вступати в різноманітні хімічні реакції.
Це дає можливість синтезувати нові сорбенти з функціональними групами різної хімічної природи.
Для сорбційного концентрування благородних металів найбільш перспективними є сорбенти, що містять у своєму складі комплексоутворювальні сірковмісні групи. Для відділення і концентрування благородних металів широко застосовують хімічно модифіковані силікагелі з прищепленими похідними тіосечовини, зокрема з функціональною N'-алілN'-пропілтіосечовинною групою.
Для концентрування металів широко використовуються також сорбенти з дитіокарбамінатною функціональною групою.
Це стосується які гетероланцюгових полімерних сорбентів, у яких дитіокарбамінатна група входить до складу матриці [5], так і хімічно модифікованих кремнеземів, у яких дітіокарбамінатна група на поверхні вводиться шляхом хімічного модифікування [7].
Було цікаво зіставити процеси сорбції на цих сорбентах із силікагелями, що містять дітіокарбамінатні та N'-алілN'-пропілтіосечовинні групи, які одержані шляхом імпрегнування поверхні силікагелю ПГМГХ і подальшої взаємодії гуанідинових груп полімеру з сірковуглецем, чи аллілізотіоціанатом.
У попередній роботі [2] нами було розглянуто особливості взаємодії галогенідних комплексів металів з таким сорбентами. У пропонованій роботі представлено дослідження процесів сорбції оловохлоридних комплексів паладію.
Об'єкт і методи досліджень
Синтез сорбентів описано в роботі [2]. Усі сорбенти були синтезовані на основі силікагелю Silika Gel 60 фірми «Merck» (фракція 0,06−0,16 мм, середній діаметр пор 12 нм, питома поверхня 260 м2/г). Як середовище для синтезу використовували дистильовану воду. Як реагенти брали перегнаний сірковуглець, полігексаметиленгуанідин хлорид (х.ч.), і алілізотіоціанат фірми «Fluka», що використовувалися без додаткового очищення.
Концентрацію сірковмісних і азотовмісних функціональних груп на поверхні синтезованих сорбентів визначали зворотним титруванням надлишку срібла за методом Фольгарда й методом кислотно-основного титрування відповідно. У табл. 1 наведено скорочені назви досліджуваних сорбентів і концентрації функціональних груп.
Таблиця 1. Характеристики синтезованих сорбентів.
сорбент неорганічний полімерний оловохлоридний Стандартний розчин паладію (ІІ) готували розчиненням точної наважки PdCb кваліфікації «ч» у 2 М розчині HCl. 0,01 М і 1 М розчин SnCl2 готували за методикою [1].
Розчин смарагдово-зеленого оловохлоридного комплексу паладію з концентрацією 25 мкг/мл готували змішуванням відповідних об'ємів розчину хлориду паладію (ІІ) у 2 М HCl і свіжоприготованого розчину хлориду олова (ІІ) у 2 М HCl при мольному співвідношенні Pd: Sn=1: 90 [6] і доводили до мітки 2 М HCl. При цьому важливим є порядок зливання реагентів: спочатку розчин паладію, кислота, а потім розчин хлориду олова (ІІ) [1]. Спостерігали утворення відповідного смарагдового комплексу паладію через яскраво-жовту стадію.
Сорбцію оловохлоридних комплексів паладію (ІІ) на сорбентах вивчали в статичному режимі за різних значень pH. Кислотність розчинів контролювали рН-метром-мілівольтметром рН-150М. Повноту сорбції розраховували як різницю між початковою і рівноважною концентрацією металу у водній фазі. Рівноважну концентрацію паладію у водній фазі визначали на атомноабсорбційному спектрофотометрі «Сатурн-2М» з термічним атомізатором.
Результати та їх обговорення. У водних розчинах утворюється широкий набір комплексів паладію (ІІ) з хлоридом олова (ІІ). Механізм взаємодії хлоридів паладію та олова досить складний і остаточно не з’ясований, утворення тих чи інших комплексів залежить від концентрації компонентів (паладію (ІІ), хлориду олова (ІІ), хлорид-іонів) і кислотності середовища [4]. Дослідження умов утворення комплексних сполук паладію (ІІ) з хлоридом олова (ІІ) у розчинах показало існування якнайменше трьох комплексних форм залежно від концентраційних умов. Найцікавішим є смарагдово-зелений оловохлоридний комплекс паладію, що характеризується яскраво вираженим максимумом поглинання при 640 нм (15 600 см-1). Він достатньо стійкий у водних розчинах і використовується в аналітичній практиці для визначення мікрокількостей паладію [1].
Для встановлення механізму сорбції оловохлоридних комплексів паладію на сорбентах із сірковмісними групами і ПГМГ-СГ були вивчені залежності сорбції іонів Pd (H) і його оловохлоридних комплексів від кислотності середовища. Як видно з рис. 1, на АПТМ-СГ і ДТКСГ, сорбція іонів паладію проходить кількісно в інтервалі pH 2−6. Час установлення сорбційної рівноваги при цьому становить 10−15 хв.
При збільшенні концентрації HCl у розчині до значення 1 моль/дм3 і вище сорбція іонів Pd (H) не відбувається. На ПГМГ-СГ паладій сорбується лише на 50%, а при значеннях рН<1 із розчину не вилучається. Іони паладію десорбується кількісно протягом 10 хв за допомогою 10% розчинів тіосечовини.
Інша картина спостерігається при сорбції оловохлоридних комплексів Pd (H).
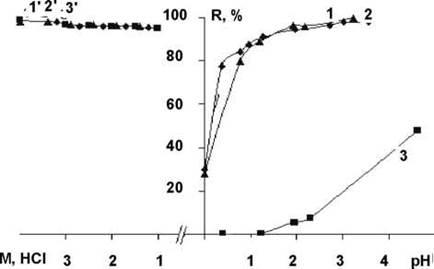
Рис. 1. Залежність сорбції іонів Pd (II) (1, 2, 3) та оловохлоридних комплексів Pd (II) (1', 2', 3') від pH розчинів і концентрації HCl: 1, 1' АПТМС-СГ, 2? 2' LNRC-CU? 3? 3' GUVU-CU
На рис. 1 (криві 1', 2', 3') видно, що ступінь вилучення паладію у вигляді оловохлоридного комплексу в інтервалі кислотності 1−4 М HCl дорівнює 95−98% на всіх досліджуваних сорбентах. Час установлення сорбційної рівноваги при цьому не перевищує 5 хв.
Усі досліджувані сорбенти при цьому набувають яскравого зеленого забарвлення. Це свідчить про іонообмінний характер сорбції зі збереженням при цьому структури оловохлоридного комплексу паладію. Однак одержаний сорбат на ПГМГ-СГ з часом зменшує інтенсивність свого забарвлення, яке протягом 3 год повністю зникає. АПТМ-СГ і ДТК-СГ, на відміну від ПГМГ-СГ, не знебарвлюються, а набувають коричневого забарвлення, характерного для сорбатів хлоридних комплексів паладію на зазначених сорбентах в оптимальних умовах сорбції [2]. Ймовірно, такі зміни забарвлення пов’язані зі зміною складу комплексу на поверхні.
Поверхня ПГМГ-СГ у розчині заряджена позитивно, тоді як оловохлоридний комплекс паладію [PdCh (SnCl3)2]2є негативно зарядженим [6]. У зв’язку з цим можна припустити, що сорбція проходить за аніоно-обмінним механізмом, про що також свідчить і висока швидкість установлення сорбційної рівноваги.
Однак із часом на поверхні АПТМ-Сг і ДТК-СГ відбувається перегрупування лігандів навколо центрального атому Pd (H) в оловохлоридному комплексі. Завдяки тому, що комплекси паладію із сірковмісними лігандами є стійкішими, то, очевидно, відбувається заміщення ліганду (SnCh)1на сірковмісні. Таким чином паладій ковалентно закріплюється на поверхні досліджуваних сорбентів. Можна припустити, що в процесі сорбції оловохлоридного комплексу паладію на АПТМ-СГ і ДТК-СГ він координується біля NH±^^ що входять до складу ПГМГХ, а потім «переходить» на сусідні функціональні групи, у складі яких є атоми сірки.
Висновки
Досліджено взаємодію оловохлоридних комплексів паладію з силікагелями, що містять сірковмісні функціональні групи. Визначено оптимальні умови сорбції оловохлоридних комплексів паладію на досліджуваних сорбентах.
Показано, що застосування SnCl2 сприяє кількісному вилученню паладію з розчинів за допомогою розглядуваних сорбентів. Установлено, що при сорбції оловохлоридних комплексів паладію на поверхні АПТМ-СГ і ДТК-СГ відбувається перегрупування з переходом іонів [PdCl2(SnCl3)2]2 з аніонообмінних груп ПГМГ фрагмента сорбенту на сірковмісні, що супроводжується його руйнуванням.
Література
- 1. Гинзбург С.И., Езерская Н. А., Прокофьева И. В. и др. Аналитическая химия платиновых металлов. М., 1972.
- 2. Лещенко В.Н., Андрианова Е. Б., Легенчук А. В.,. Трофимчук А.К. Сравнительное концентрирование металлов сорбентами с серосодержащими функциональными группами, закрепленными на поверхности различными способами // Доп. НАН України. 2006. № 12. С. 54−57.
- 3. Лисичкин Г. В., Кудрявцев Г. В., Нестеренко П.Н. Химически модифицированные кремнеземы и их применение в неорганическом анализе // Журн. аналит. хим. 1983. Т. 38, № 9. С. 1684−1705.
- 4. Лосев В.Н., Кудрина Ю. В., Трофимчук А.К. Особенности взаимодействия оловохлоридных комплексов палладия и платины с (2,6диметил-4-метилентрифенилфосфонийхлорид)фенил N-пропилтиомочевинными группами, ковалентно закрепленными на поверхности кремнезема // Журн. неорг. хим. 2003. Т 48, № 6. С. 923−930.
- 5. Малофеева Г. И., Петрухин О.М. Хелатообразующие гетероцепные сорбенты на основе аминов различной основности и их применение для концентрирования металлов // Журн. аналит. хим. -1992. Т. 47, № 3. С. 456−465.
- 6. Шленская В. И., Бирюков А. А., Морякова Л. Н. Спектрофотометрическое исследование условий образования комплексных соединений палладия (ІІ) с хлоридом олова (ІІ) в растворах// Журн. неорг. химии. 1969. Т. 14, № 2. С. 496−501.
- 7. Donald E. Leyden, G. Howard Luttrell. Preconcentration of trace metals using chelating groups immobilized via silylation // Anal. Chem. 1975. Vol. 47, № 9. P. 1612−1618.