Енергія Гіббса і напрямок протікання реакції

Де — зміна ентальпії реакції при температурі Т, Дж/моль; — зміна ентропії реакції при температурі Т, Дж/(моль · град); Т — температура реакції, К. Для визначення температури, при якій протікання реакції найбільш ймовірно, знаходять залежність енергії Гіббса від температури. Значення температур, при яких ДG < 0, буде відповідати значенням температур можливого перебігу процесу. Для цієї реакції… Читати ще >
Енергія Гіббса і напрямок протікання реакції (реферат, курсова, диплом, контрольна)
Характер зміни енергії Гіббса ДG дозволяє судити про принципову ймовірність здійснення процесу (тобто, якщо енергія Гіббса у вихідному стані системи більше, ніж у кінцевому, то процес принципово може протікати, якщо навпаки — то ні):
ДG < 0 — процес може протікати;
ДG > 0 — процес протікати не може;
ДG = 0 — система знаходиться у стані хімічної рівноваги.
Для визначення температури, при якій протікання реакції найбільш ймовірно, знаходять залежність енергії Гіббса від температури.
G = f (T).
Значення температур, при яких ДG < 0, буде відповідати значенням температур можливого перебігу процесу [2, 3].
Енергія Гіббса розраховується за рівнянням Гіббса — Гельмгольца, Дж/моль:
(1.4).
де — зміна ентальпії реакції при температурі Т, Дж/моль; - зміна ентропії реакції при температурі Т, Дж/(моль · град); Т — температура реакції, К.
Розрахунок змін ентальпії та ентропії реакції при температурі Т проводиться за такими формулами:
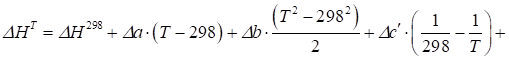
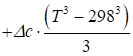
; (1.5).
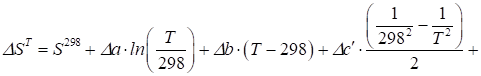
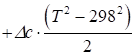
(1.6).
де — стандартна ентальпія реакції при температурі 298 К, Дж/моль; - стандартна ентропія реакції при температурі 298 К, Дж/(моль · град);, , , — коефіцієнти у поліномі.
Ср = f (T).
для цієї реакції (c — як правило, для органічних сполук, а сI — як правило, для неорганічних сполук):
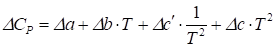
(1.7).
де — теплоємність речовини при постійному тиску, Дж/(моль · град).