Огляд існуючих промислових методів виробництва

На окислення іонів СlО — на аноді до СlО3 — витрачається значна частка струму, отже, зазначені процеси є небажаними. Таким чином, вихід за струмом продукту, що позначається зазвичай А, залежатиме від ретельності поділу катодних і анодних продуктів. Крім того, вихід за струмом залежить від концентрації їдкого натру в католіті, від розчинності хлору в аноліті, а остання пов’язана з концентрацією… Читати ще >
Огляд існуючих промислових методів виробництва (реферат, курсова, диплом, контрольна)
Сировиною для електролізу служить хлорид натрію у вигляді кам’яної солі. Підготовка сировини до електролізу включає операції розчинення, очищення розсолу від механічних домішок і видалення іонів кальцію і магнію. Механічні домішки видаляють відстоюванням розсолу з наступним фільтруванням осаду, а іони кальцію і магнію, які негативно впливають на процес електролізу, обробкою розсолу розчином карбонату натрію або вапняним молоком:
СаСl + Na 2 CO 3 > СаСО 3 + 2 NaCl.
з наступною нейтралізацією надлишкової лужності соляною кислотою. Осад карбонатів кальцію і магнію видаляють фільтруванням.
Отриманий розсіл повинен мати концентрацію солі 310−315 р./л, щоб забезпечити, більш низький потенціал розряду іонів при електролізі. Також існують допустимі межі вмісту іонів кальцію і магнію.
Розсіл, що надходить на електроліз, представляє багатокомпонентну систему, в якій містяться іони натрію, хлору, гідроксонію-катіон і гідроксид-аніон. Розрізняють два варіанти технологічного процесу електролізу водного розчину хлориду натрію: електроліз із твердим катодом залізним (діафрагмовий метод) і електроліз з рідким ртутним катодом.
Аноди електролізерів в обох випадках виготовляють з однакових матеріалів: штучного графіту, просоченого для зменшення зносу льняним маслом, або з титану, покритого шаром оксидів ртуті і титану. Аноди другого типу дозволяють вести електроліз при високій щільності струму і більш низькій напрузі. Такі умови знижують витрату електроенергії на 10−12%. Тому оксидно-ртутні аноди витісняють графітові: ними оснащено в даний час до 70% всіх установок електролізу. Для забезпечення високих виходів за струмом газоподібного хлору, можна сформулювати такі вимоги й умови для технології електролізу:
- 1. Для електролізу використовують концентровані, насичені розчини хлоридів лужних металів; наприклад, концентрація NaCl у розчинах, що подаються на електроліз, складає 310 ± 5 гдм-3;
- 2. Розчин, який подається на електролізер, підкислюють соляною кислотою до рН приблизно чотирьох, тому що в цих умовах газоподібний хлор термодинамічно стійкий.
- 3. Застосовують анодні матеріали з високою перенапругою виділення кисню і низькою перенапругою виділення хлору, наприклад ОРТА. Важливість виконання цієї вимоги ілюструється парціальними поляризаційними кривими, які наведені на рис. 1.1.
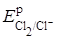
З досягненням анодного потенціалу, більш позитивного за рівноважний потенціал реакції (3.6), на аноді починається виділення кисню. Проте, оскільки перенапруга виділення кисню велика (крива 1 на рис. 3.5), то вже при малих густинах струму досягаються потенціали анода більш позитивні за і починає проходити процес виділення хлору c низькою перенапругою (крива 2). Проводимо еквіпотенціальну лінію при робочому потенціалі анода (Еа=1,42 В) до перетинання з поляризаційними кривими і знаходимо силу струму (, що витрачається на кожен процес. У даному прикладі.
= 45…60 Ам-2, а =1450 Ам-2.
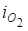
Звідси.
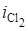
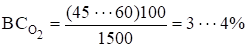
і, отже, вихід за струмом хлору складає 96…97%.
Таким чином, завдяки застосуванню анодного матеріалу з високою перенапругою виділення кисню і низькою перенапругою хлору, основним процесом на аноді є утворення хлору.
Аналізуючи хід парціальних поляризаційних кривих (рис. 1.1), можна зробити висновок про те, що чим вище робоча густина струму, тим більшого виходу за струмом хлору слід очікувати. Тому електроліз рекомендується вести за густиною струму: діафрагмовим методом — 1500…2500 Ам-2, мембранним — 2000…4000 Ам-2, із ртутним катодом — 6000…15 000 Ам-2.
- 4. Для зниження напруги на електролізері і питомої витрати електроенергії електроліз доцільно проводити при підвищених температурах — 358…369 К. Такі технологічні параметри диктуються кінетикою електродних процесів і витратою електроенергії і можуть уточнюватися при конкретному методі електролізу.
- 5. Надійний розділ анодних і катодних продуктів. При електролізі водних розчинів хлоридів лужних металів в зоні потенціалів негативніше лінії а рівноваги води з воднем, на твердому металевому катоді буде проходити реакція:
- 2Н2О + 2е = 2ОН- + Н2
з накопиченням лугу в католіті і виділенням водню.
Якщо анодні продукти (Cl2, рН < 4) не відокремити від катодних (NaOH ~ 100…140 гдм-3), почнуть проходити побічні процеси 2, 4, 5, 12 і 18 з утворенням гіпохлориту, хлориту і хлорату натрію, і цільових продуктів не одержимо.
Для відділення анодного простору з кислим розчином від катодного, заповненого розчином лугу, застосовують катіонообмінні мембрани і пористі діафрагми. В залежності від виду роздільного елемента в промисловості застосовують три методи електролізу водних розчинів хлориду натрію:
- · діафрагмовий з твердим катодом;
- · мембранний з твердим катодом;
- · бездіафрагмовий з ртутним катодом.
Розглянемо більш докладно кожний з них.
Кожен їх зазначених способів відрізняється реакціями, що протікають. У діафрагмовому способі на твердому катоді відбувається розряд іонів водню, що містить залишкові кількості NаСl. На аноді подається гарячий очищений розсіл і утворюється газоподібний хлор. Рух розсолу з анодного в катодний відбувається за рахунок різниць рівнів аноліта і католіта.
Катодний процес. При електролізі водного розчину хлориду натрію на твердому, наприклад, залізному катоді, виділяється водень і в католіті утворюється луг.
2Н2О +2 е > Н2 +2 ОН Різні іони розряджаються при різних значеннях потенціалу. Це властивість іонів і дозволяє використовувати електроліз для розділення сумішей речовин. Мінімальний потенціал електорода, необхідний для розряду даного іона при концентрації його в розчині, що дорівнює 1екв / л, називають нормальним електродним потенціалом і позначають через Е0. Для багатьох іонів значення Е0 відомі і наводяться у довідковій літературі.
У практичних умовах розряд іонів на електродах відбувається при більш високих значеннях потенціалу, ніж теоретичне. Різниця між значеннями дійсного та оборотного електродного потенціалу називається поляризацією, яка зростає із збільшенням щільності струму.
Лімітуючою стадією процесу електролізу може бути стадія розряду іонів — гальмування процесу за рахунок електрохімічної стадії (виникає при протіканні струму), що призводить до появи перенапруги — поляризації. На поляризацію в цьому випадку впливає зміна умов ведення електролізу. Так, наприклад, для зменшення поляризації виділення водню залізний катод покривають нікелем або кобальтом (каталізатором), що знижує потенціал виділення водню.
Розряд іонів натрію на сталевому катоді не відбувається внаслідок високого від'ємного значення стандартного потенціалу реакції.
Nа + е > Nа, рівного — 2.714 В Крім основного процесу, що протікає на аноді 2Сl > Сl2, в анодному просторі електролізера протікає ряд побічних реакцій, що зменшують вихід по струму, наприклад:
4ОН — - 4е > О2 + Н2О Хлор, що виділяється на аноді, частково розчиняється в електроліті, взаємодіючи з водою відповідно до реакціями Сl2 + Н2О — НСlО + НСl, Сl2 + ОН- - НСlО + Сl ;
На окислення іонів СlО — на аноді до СlО3 — витрачається значна частка струму, отже, зазначені процеси є небажаними. Таким чином, вихід за струмом продукту, що позначається зазвичай А, залежатиме від ретельності поділу катодних і анодних продуктів. Крім того, вихід за струмом залежить від концентрації їдкого натру в католіті, від розчинності хлору в аноліті, а остання пов’язана з концентрацією NаСl: чим вище концентрація NаСl в аноліті, тим нижче розчинність хлору. Розчинність хлору у водних розчинах концентрацією NаСl знижується також з підвищенням температури. Цим і пояснюється прагнення направити на електроліз практично насичений водний розчин концентрацією NаСl і вести процес при температурі 85- 900С. Вихід хлору і луги по струму в цих умовах складає 92−96%.