Стандартний водневий електрод.
стандартні електродні потенціали

Как было сказано выше абсолютное значение скачка потенциалов на границе электрод-раствор экспериментально измерить нельзя. Для практического определения электродного потенциала поступают следующим образом: опытным путём измеряют ЭДС гальванического элемента, состоящего из двух электродов, причем потенциал одного из них условно принимают за нуль. При условии, что активность потенциалопределяющих… Читати ще >
Стандартний водневий електрод. стандартні електродні потенціали (реферат, курсова, диплом, контрольна)
Как было сказано выше абсолютное значение скачка потенциалов на границе электрод-раствор экспериментально измерить нельзя. Для практического определения электродного потенциала поступают следующим образом: опытным путём измеряют ЭДС гальванического элемента, состоящего из двух электродов, причем потенциал одного из них условно принимают за нуль.
Международным эталоном сравнения электродных потенциалов является стандартный водородный электрод (рис. 4.2). Это платиновая пластина, покрытая платиновой чернью и насыщенная водородом Н2 при р=1 атм. Пластина опущена в раствор, где активность ионов водорода = 1 моль/дм3. Платина катализирует электродный процесс 2H+ +2e — H2. Электрохимическая схема стандартного водородного электрода:
Pt, H2 (p = 1атм)|H2SO4 (= 1моль/дм3).
При этих условиях электродный потенциал водородного электрода принят за нуль = 0 и не зависит от температуры.
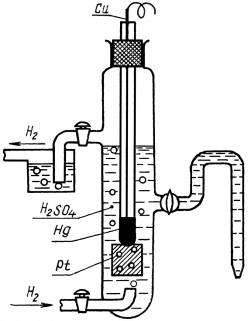
Рис. 2 Схема водородного электрода
На основе решений Международной конвенции (Стокгольм, 1953) для определения электродного потенциала составляют гальваническую цепь, состоящую из измеряемого электрода и стандартного водородного электрода. При записи электрохимических цепей слева записывается электрод с меньшим значением электродного потенциала (анод), справа — с большим значением (катод). Например:
- (-) Zn|ZnSO4||CuSO4|Cu (+)
- (-) Zn — 2e > Zn2+ — процесс окисления
- (+) Cu2+ + 2e > Cu — процесс восстановления
______________________________________
Zn+Cu2+>Zn2++Cu — суммарная токообразующая реакция Схема электрохимической цепи с водородным электродом правильно записывается в следующей последовательности: слева стандартный водородный электрод, далее ПОИ или весь электролит и потом электрод:
Pt, H2 (p=1)|H2SO4 (= 1) || ZnSO4 | Zn.
В гальваническом элементе электроны пойдут от цинка к водородному электроду.
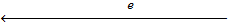
Pt, H2 (p = 1) | H2SO4 (= 1) || ZnSO4 | Zn.
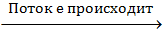
справа налево Здесь пойдет такая же реакция, как если бы цинк опустили в раствор серной кислоты (H2SO4). Электроны стали бы перемещаться от цинка к кислоте.
Zn + H2SO4 (p-p) ZnSO4 + H2
Для неактивных металлов, например меди, поток электронов идет от водородного электрода к медному электроду.
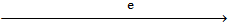
Pt, H2 (p=1)|H2SO4 (a=1)||CuSO4|Cu.
слева направо Измеряют ЭДС гальваноэлементе в равновесных условиях.
Считают, что если поток электронов идет справа > налево, то ЭДС отрицательная; если поток электронов идет слева > направо, то ЭДС положительная.
В первом случае с цинком значение ЭДС отрицательное, во втором случае с медью значение ЭДС положительное, когда поток электронов идет слева > направо.
Так как значение потенциала стандартного водородного электрода принято за нуль (= 0), то ЭДС цепи равна электродному потенциалу измеряемого электрода.
При условии, что активность потенциалопределяющих ионов aПОИ= 1моль/дм3, электродные потенциалы называют стандартными, значения табулированы при 25єС, они зависят от химической природы электрода, от заряда его ионов в растворе и выражаются в вольтах (В).
Расположенные в порядке возрастания стандартных электродных потенциалов металлы представляют собой известный ряд напряжения металлов.
Если aПОИ ?1, то электродный потенциал ц не является стандартным и его зависимость от концентрации ионов определяется уравнением Нернста.