Взаємозв'язок між константою розчинності і розчинністю

Підставляючи (8.8) і (8.9) в рівняння концентраційної константи розчинності, можна отримати формулу, по якій обчислюють константу розчинності, коли відома концентрація формульних одиниць: Протоліз іонів малорозчинного електроліту. Як аніон, так і катіон малорозчинного електроліту в розчині можуть взаємодіяти з молекулами розчинника, іонами ліонія або ліата. Константи протолітичних пар… Читати ще >
Взаємозв'язок між константою розчинності і розчинністю (реферат, курсова, диплом, контрольна)
З рівняння (8.2) виходить, що при розчиненні 1 міль формульних одиниць в розчин переходять р міль катіонів і q міль аніонів. Тому між молярною концентрацією формульних одиниць і концентраціями іонів існують наступні залежності:

Підставляючи (8.8) і (8.9) в рівняння концентраційної константи розчинності, можна отримати формулу, по якій обчислюють константу розчинності, коли відома концентрація формульних одиниць:
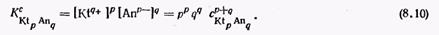
Виражаючи звідси концентрацію формульних одиниць, що є молярною розчинністю малорозчинного електроліту, отримують рівняння для обчислення розчинності по відомій константі розчинності:
Причини зміни розчинності малорозчинного електроліту

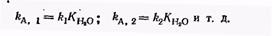
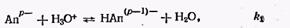
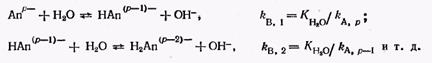
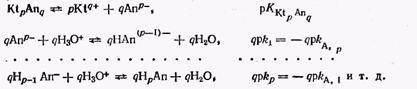
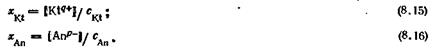
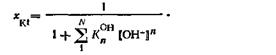


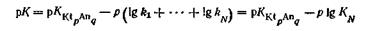
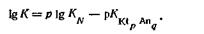
Іонна сила. Зміну іонної сили розчину викликають зміни твору коефіцієнтів актівностей Пг [(див. 8.4)1 і тим самим — концентраційної константи розчинності.
Введення побічного електроліту збільшує іонну силу розчину і внаслідок цього коефіцієнти активності іонів малорозчинного електроліту і добуток Пg зменшуються. Згідно (8.12) це викликає збільшення концентраційної константи розчинності.
Отже, у присутності побічного електроліту розчинність малорозчинного електроліту збільшується. Оскільки при дослідженні цього явища як побічні електроліти зазвичай застосовують добре розчинні солі (наприклад, Кс1, NaСl, NaNO3 і т. п.), воно отримало назву «Сольового ефекту». «Сольовий ефект» тим більше, чим вище зарядність іони як побічного, так і малорозчинного електроліту. У першому випадку введення побічного електроліту викликає великі зміни іонної сили розчину, а в другому — коефіцієнти активності зменшуються швидше.
Однойменний (загальний) іон. Активності (концентрації) катіона і аніона малорозчинного електроліту в розчині не можуть вільно змінюватися, оскільки вони взаємозв'язані виразом константи розчинності. Збільшення активності (концентрації) одного з цих іонів спричиняє за собою зменшення активності (концентрації) іншого. Це рівнозначно зменшенню концентрації розчинених формульних одиниць малорозчинного електроліту (молярній розчинності цієї речовини).
При постійній іонній силі розчину, коли концентраційна константа розчинності постійна, Проте введення в розчин значних кількостей електроліту, що містить однойменний іон, викликає помітні зміна іонної сили. Розрахунки в подібних випадках слід вести по термодинамічній константі розчинності. Якщо, наприклад, побічний електроліт має з малорозчинним електролітом загальний аніон, слід використовувати вираз.
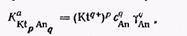
Тут сAn = [Аnр-]+ [Аnр-]', де [Аnр-]- концентрація аніона, що виникає в результаті розчинення малорозчинного електроліту; [Аnр-]'- концентрація аніона, створена в розчині побічним електролітом. При порівнянних концентраціях розрахунок досить складний. Проте інтерес представляє випадок, коли [Аnр-]'>>[Аnp-]. Тоді розрахунок можна вести по рівнянню.
Діленням обчисленого значення концентрація катіона на р отримує молярну розчинність малорозчинного електроліту.

Протоліз іонів малорозчинного електроліту. Як аніон, так і катіон малорозчинного електроліту в розчині можуть взаємодіяти з молекулами розчинника, іонами ліонія або ліата.
Гідратовані катіони у водних розчинах є кислотами:
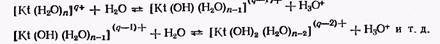
Ці реакції можуть бути розглянуті теж як реакції утворення гидроксокомплексов:
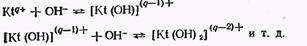
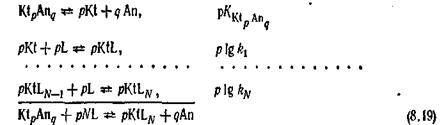
Константи протолітичних пар, що утворилися при ступінчастому протолізі (kа, 1, kа, 2 …), взаємозв'язані із ступінчастими константами утворення гидроксокомпл…
Осаджувач, властивості. | Надлишкова кількість осаджувача,%. |
Літкий. | 200%. |
Неліткий. | 30%. |
Вимоги до осаджувача:
- — специфічний, селективний по відношенню до осаджуемого іону;
- — леткий, віддаляється при нагріванні, або прожарюванні осадженої форми.
Рис.
