Дослідження фосфорної кислоти

Визначення загальної кількості заліза (II і III) фотоколориметричним методом з сульфосаліциловою кислотою. Оскільки спочатку ми визначали рН для кожного зі значень концентрації, то отримали наступну таблицю: В даній курсовій роботі для дослідження фосфорної кислоти було вибрано такі типи аналізів: За результатами 2 паралельних дослідів було отримано наступні результати за формулою (2.2): Даний… Читати ще >
Дослідження фосфорної кислоти (реферат, курсова, диплом, контрольна)
Методика лабораторних досліджень
В даній курсовій роботі для дослідження фосфорної кислоти було вибрано такі типи аналізів:
- · Визначення загальної кількості заліза (II і III) фотоколориметричним методом з сульфосаліциловою кислотою
- · Об'ємне визначення фосфорної кислоти потенціометричним методом
- · Визначення фосфора фотоколориметричним методом
Розглянемо більш детально ці методики.
Об'ємне визначення фосфорної кислоти потенціометричним методом
Даний аналіз проводили за методикою, описаною в пункті 2.2 даної курсової роботи.
Оскільки спочатку ми визначали рН для кожного зі значень концентрації, то отримали наступну таблицю:
Таблиця 3.1 Залежність рН розчинів ортофосфатної кислоти від об`єму доданого NaOH.
V (NaOH). | |||||||||
рН. | 0,6. | 0,62. | 0,66. | 0,72. | 0,79. | 0,84. | 0,89. | 0,96. | 1,01. |
V (NaOH). | |||||||||
рН. | 1,1. | 1,16. | 1,2. | 1,28. | 1,35. | 1,4. | 1,47. | 1,56. | 1,63. |
V (NaOH). | |||||||||
рН. | 1,71. | 1,8. | 1,88. | 1,93. | 2,06. | 2,15. | 2,33. | 2,58. | 3,02. |
V (NaOН). | |||||||||
рН. | 4,8. | 5,66. | 5,99. | 6,24. | 6,46. | 6,68. | 6,94. | 7,28. | 8,17. |
V (NaOH). | |||||||||
рН. | 10,04. | 10,43. | 10,65. | 10,82. | 10,96. | 11,2. | 11,2. | 11,3. |
У даному випадку ми титруємо ортофосфатну кислоту лугом і за значеннями pH визначаємо кінцеву точку титрування.
Кислота відтитровується наступним чином:
тому маємо 2 скачка титрування:
Рисунок 3.1 Графік залежності рН розчину фосфорної кислоти від об'єму NaOH.
На графіку зображений 1 та 2 скачок титрування:
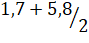
рН1 = =3,8.
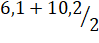
рН2 = = 8,15.
Відсутність третього скачка титрування можна пояснити тим, що концентрація титранта була недостатньою, а також особливостями самої сполуки. Як відомо, в трьохосновних кислотах третій атом відтитрувати та зафіксувати точку еквівалентності досить складно.
При рН 3,8 V (NaOH)=55 см3
При рН 8,15 V (NaOH) = 73 см3
Отже, в загальному на титрування було витрачено близько 73 см3 розчину NaOH. Для підтвердження результатів було проведено паралельне титрування.
За результатами 2 паралельних дослідів було отримано наступні результати за формулою (2.2):